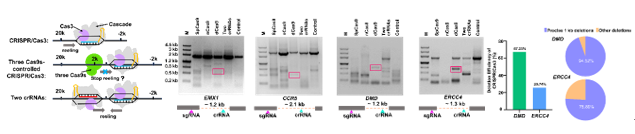
迄今,CRISPR-Cas9及Cas12系统已被广泛用于基因组编辑,但其精确缺失大片段基因组的效率较低。CRISPR Type Ⅰ型系统已经被证明在真核细胞中实现了高效率大片段基因敲除,以Type I系统中研究最为清楚的I-E亚型为例,5个不同蛋白组成的超大复合物Cascade 可识别Type I-E型的靶标DNA,而靶标DNA的切割则由具有解旋酶及核酸酶双重功能蛋白Cas3来执行。只有当CRISPR RNA和靶标DNA互补配对且最终形成R-loop时,Cas3才会特异性地募集到Cascade上并被激活酶活性,从而降解上游区域并导致不可预测的基因组大片段缺失。因此,如何精准控制Type I-E介导的DNA片段缺失,具有重要的科学及应用价值。
2024年3月15日,bevictor伟德李占军教授团队在Science子刊《Science Advances》期刊发表了题为“Precise large-fragment deletions in mammalian cells and mice generated by dCas9-controlled CRISPR/Cas3”的研究成果。该研究证明了dCas9可用于精确调控Type I-E介导的DNA片段缺失,并首次将该系统用于动物模型构建,成功构建了Y染色体完全及部分敲除基因编辑小鼠。
首先,研究人员基于位点特异性DNA结合蛋白可能会阻止Cas3解旋dsDNA的研究策略,将四种DNA结合蛋白(SpCas9、nCas9、dCas9和两种不同方向的crRNA)用于该研究。结果显示,在所测试的位点中,dCas9协助Type I-E均产生了精准的基因缺失,而其他3种结合蛋白则呈现较杂乱的敲除方式。
基于该策略,研究人员利用3条靶向Y染色体的crRNA,成功构建了Y染色体敲除小鼠,该小鼠模型具有性反转、Y染色体缺失、生殖结构异常等为特纳综合征(Turner syndrome)表型。进一步,通过设计位于性别决定基因(Sry基因)3'端的dCas9的sgRNA,以期实现CRISPR Type I-E介导的大片段基因精确敲除动物模型。结果表明,在dCas9的调控下,实现了部分Y染色体敲除小鼠,但保留了Sry基因,该小鼠模型未发生性反转,但其生殖功能严重障碍。
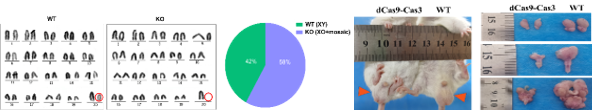
综上,本研究利用dCas9阻止Cas3解旋dsDNA的研究策略,实现CRISPR Type I-E系统介导的大片段基因组精准缺失,同时验证了该策略在细胞及动物模型构建中的有效性,有望用于非整倍体疾病及额外染色体的片段插入等人类临床疾病的致病机制研究及基因治疗。
bevictor伟德博士研究生李金泽,动物医学学院博士研究生赵丁、张涛为共同第一作者,李占军教授,赖良学教授,隋婷婷副教授,为共同通讯作者。
原文链接:https://www.science.org/doi/10.1126/sciadv.adk8052